「CRA(臨床開発モニター)の仕事が忙しい時はいつになるのでしょうか?」の質問と回答のページです。質問に対しての回答投稿が可能です。マナーを守って有意義に利用しましょう。(削除申請はこちらからお願いします)
CRA(臨床開発モニター)の仕事が忙しい時はいつになるのでしょうか?
 質問
質問

CRA(臨床開発モニター)の仕事が忙しい時はいつになるのでしょうか?
よくCRA(臨床開発モニター)は繁忙期があって忙しいと聞きますが、実際いつが繁忙期になるのでしょうか。また、どれぐらい忙しいのでしょうか。 2016年8月16日
2016年8月16日  12396
12396
 AIによる要約
AIによる要約
 マンガでわかる
マンガでわかる

 イラスト・図解でわかる
イラスト・図解でわかる
 みんなの回答一覧
みんなの回答一覧
- 試験立ち上げ時、SAE対応時以外にも、逸脱発生時、症例エントリーが進んだときなどがあります ベストアンサー
-
治験実施施設の選定から、IRB(治験審査委員会)での治験実施の審議、キックオフミーティングなど、試験立ち上げ時は短期間に実施すべき事項が多いため、CRA(臨床開発モニター)は、連日出張が続いたりして忙しくなります。
またSAE(重篤な有害事象)発生時にも、医師が作成するSAE報告書作成のサポートや、報告書の医療機関での審議、治験依頼者を通じての当局への報告など、行政の通知で期限が決められている報告への対応は、時間的猶予があまりありませんので、残業してでも報告書の提出期限を守らなければなりません。
上記以外にも、治験実施計画書を遵守していない事項(逸脱)が発生した場合、逸脱の発生原因を可能な限り特定し、再発防止策を検討して実行しなければなりませんので、一時的に忙しくなります。
また、症例エントリーが一気に進むと、直接閲覧による適格性の確認などが増えます。この場合も、CRA(臨床開発モニター)は連日、出張となるでしょう。
 2016年10月11日
2016年10月11日
役に立った(5)
- SAE(Serious Adverse Event/重篤な有害事象)の発生時にCRA(臨床開発モニター)はとても忙しくなる ベターアンサー
-
SAE(Serious Adverse Event/重篤な有害事象)が発生するとCRA(臨床開発モニター)は急に忙しくなります。例えば治験中に患者様が亡くなってしまうと、それはSAEとして処理されます。
SAEは安全性情報のPMDAへの届け出義務の都合上、原則として発生後24時間以内に製薬会社へ報告をする必要があります。つまりCRA(臨床開発モニター)はSAE発生後、24時間以内に報告書類を作成する必要があるのです。報告書を作成するために、CRA(臨床開発モニター)はまず、治験薬との因果関係を医師へ確認します。その後、疾患名や患者様の情報を合わせて記載して報告書としてまとめます。患者様の情報は医師以外にも治験コーディネーター(CRC)の協力も得て集めます。
患者様が亡くなること以外に、予定外の入院などもSAEとして扱われます。オンコロジー(がん)領域や重要度の高い難治性の疾患の治験では同じ人が何回も予定外の入院をする場合があり、CRA(臨床開発モニター)はその都度、急いで報告書を作成して提出する必要があります
SAEは深夜・休日に関わらず発生する可能性があるうえ、SAEの処理は制限時間があるため、CRA(臨床開発モニター)はSAEが発生すると瞬間的にとても忙しくなると言えます。
 2016年8月16日
2016年8月16日
役に立った(2)
- 治験の立ち上げ時期が最も忙しい
-
治験の立ち上げ時期が最も忙しいです。具体的には治験の初回申請~スタートアップまでです。
初回申請はIRBへ提出する書類を作成することで、作成する書類が多いうえに、様々な部署へ確認する必要があるため、てんやわんやになります。グローバル治験の場合は、海外との折衝も同時に行うため、さらに忙しくなります。そのため、大手では立ち上げをサポートする専門の部隊があることが多いです。スケジュールは常にギリギリに設定されているため、締め切りに追われて、夜遅くまで書類の修正と確認作業に追われる日が続きます。
スタートアップ時には医療機関へ訪問して治験についての説明を行うのですが、複数の医療機関へ訪問しながら、必要な資料を作成・修正したりする必要があるため、モニターには体力も必要な時期と言えます。
 2016年8月17日
2016年8月17日
役に立った(1)
- 試験の立ち上げとデータ固定の時期は忙しい
-
外資系CROでCRAをしています。
CRAは基本的には忙しさを自身でコントロールしやすい職種だと思いますが、「試験の立ち上げ」「データ固定」の時期は確実に繁忙します。
 2026年2月12日
2026年2月12日
役に立った(0)
- データベースロック前や文書改訂の発生時
-
立ち上げ時だけでなく、データベースロック前や文書改訂が発生した場合も忙しくなることがあります。
データ解析後は症例報告書などのデータ修正が原則できません。そのため、解析前にはすべてのクエリを解決し、データを完全な状態(データベースロック)にする必要があるのですが、ロック直前に大量のクエリが一斉に発生すると、対応が追いつかず大変です。
また、GCPやプロトコールの改訂が発生した時も忙しくなります。
特にプロトコールの改訂はIRBの審査が必要であり、責任医師との再合意や、被験者への改訂内容の確認などを行う必要があります。CRAは治験担当医師やCRCに改訂内容を説明する必要があるため忙しくなります。
 2024年12月3日
2024年12月3日
役に立った(0)
- CRAの忙しい時期について
-
治験の立ち上げ時期と終了時期が特に忙しくなります。立ち上げ時期には、IRB申請資料の作成や治験施設との契約手続きなど、短期間で多くの書類作成が必要になります。治験終了間際はデータの最終確認のため、クエリー対応や報告書の作成などが集中します。
治験開始から数ヶ月経つと業務量は徐々に落ち着き、施設訪問のスケジュールも立てやすくなり、比較的計画的に仕事を進められるようになります。
最近は分業が進み、繁忙期には専門的にフォローを行うチームがいる企業も増えており、以前のような月に50時間を超えるような残業はほとんど見られなくなっていると思います。
 2024年1月26日
2024年1月26日
役に立った(0)
- 以下の記事も参考にしてください。 公式
-
<類似の質問>
https://cra-bank.com/keijiban?gu=34
(CRAの辛いこと、大変なことはなんでしょうか)
https://cra-bank.com/keijiban?gu=27
(CRAの悩みって何でしょうか?)
https://cra-bank.com/keijiban?gu=51
(CRAの休日の電話対応の頻度について)
<類似の記事>
https://cra-bank.com/cranohyoubankigyoutaisyoku
(CRAを辞めたい理由)
 2022年5月5日
2022年5月5日
- CRAの繁忙期について AI
-
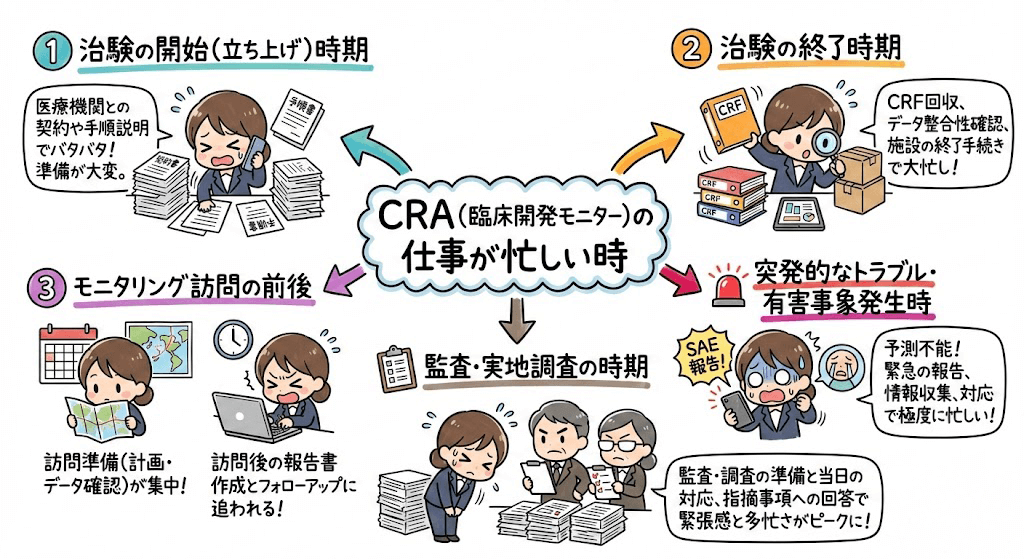
CRAの仕事は、治験の進捗状況によって業務量が大きく変動するため、繁忙期と閑散期の差が大きいと言われています。具体的にいつが繁忙期になるのか、どれくらい忙しいのかを解説します。
CRAの繁忙期
CRAの繁忙期は、主に以下の時期です。
◆ 治験の開始時期(立ち上げ時期): 治験を開始するためには、多くの準備作業が必要です。治験実施施設(病院など)への説明、契約手続き、治験で使用する資料の準備・配布など、多岐にわたる業務を同時進行で行う必要があります。特に、複数の施設で同時に治験を開始する場合は、非常に忙しくなります。
◆ 治験の終了時期(終了作業): 治験が終了すると、データの回収・確認、症例報告書(CRF)の回収・確認、治験薬の回収など、多くの作業が発生します。また、治験結果をまとめた報告書作成の準備なども行うため、業務量が増加します。
◆ データベースロック前: 治験データを確定する前(データベースロック前)には、データの最終確認作業が集中します。データの不備や矛盾がないかを入念にチェックする必要があり、非常に重要な時期です。
◆ 文書改訂が発生した場合: 治験実施計画書(プロトコル)や症例報告書などの文書に改訂があった場合、関連する作業が発生します。改訂内容の周知、資料の更新、関係者への連絡などを行う必要があります。
◆ 当局対応時: 規制当局(PMDAなど)からの問い合わせや資料提出要求があった場合、対応に追われることがあります。
これらの時期は、CRAにとって特に忙しくなる時期と言えます。
どれくらい忙しいのか?
繁忙期の忙しさは、担当する治験の数や規模、進行状況、所属する企業(CROまたは製薬会社)などによって異なります。
◆ 残業時間の増加: 繁忙期は残業時間が増加する傾向にあります。場合によっては、深夜まで残業したり、休日出勤が必要になることもあります。
◆ 出張の増加: 特に治験の開始時期や終了時期は、複数の施設を訪問する必要があるため、出張が多くなる傾向があります。
◆ プレッシャーの増加: データの確認や報告書作成など、重要な業務が集中するため、精神的なプレッシャーも大きくなります。
◆ 複数の業務の同時進行: 複数の治験を同時に担当している場合、それぞれの治験の状況に合わせて業務を進める必要があり、マルチタスク能力が求められます。
ただし、繁忙期が終われば、比較的落ち着いた時期(閑散期)になります。閑散期は、定時で帰れる日も多く、自分の時間を有効に使うことができます。
繁忙期を乗り切るためのポイント
CRAとして働く上で、繁忙期を乗り切るためのポイントをいくつか挙げます。
◆ 計画的な業務遂行: 業務の優先順位をつけ、計画的に進めることが重要です。
◆ タイムマネジメント: 時間管理を徹底し、効率的に業務を進めることが求められます。
◆ コミュニケーション能力: 関係者との円滑なコミュニケーションを図り、情報共有を密に行うことで、業務の遅延を防ぐことができます。
◆ 体調管理: 繁忙期は体力的にも精神的にも負担が大きくなるため、十分な休息と睡眠を取り、体調管理に気を配ることが重要です。
◆ 周囲のサポート: 上司や同僚に相談したり、サポートを受けたりすることで、負担を軽減することができます。
まとめ
CRAの仕事は、治験の進捗状況によって業務量が大きく変動します。特に、治験の開始時期、終了時期、データベースロック前、文書改訂時、当局対応時などは繁忙期となり、残業時間の増加、出張の増加、プレッシャーの増加などが生じます。しかし、繁忙期を乗り切れば、比較的落ち着いた時期を迎えることができます。計画的な業務遂行、タイムマネジメント、コミュニケーション能力、体調管理などを意識することで、繁忙期を乗り切り、CRAとして活躍していくことができるでしょう。
項目 詳細 忙しさの程度 具体的な業務内容 治験開始時期(立ち上げ時期) 治験を開始するために、医療機関の選定・契約、治験審査委員会(IRB)への申請、治験の説明会(キックオフミーティング)の開催など、多くの業務が集中する時期。 ◆ 出張が多くなる。
◆ 複数の医療機関と同時並行でやり取りを行う必要があり、連絡業務や資料作成に追われる。
◆ 短期間で多くのタスクをこなす必要があり、残業時間が増える傾向にある。◆ 医療機関への訪問・説明
◆ 契約書作成・締結
◆ IRB資料作成・申請
◆ 治験薬の搬入準備
◆ 治験担当者への教育・研修治験実施期間中 治験が進行している期間は、定期的なモニタリング訪問を行い、治験が適切に実施されているかを確認する。 ◆ モニタリング訪問の頻度や期間は、治験の規模や種類によって異なる。
◆ 緊急性の高い事象が発生した場合、迅速な対応が求められる。
◆ データ収集・確認作業に時間を要する場合がある。◆ モニタリング訪問(医療機関への訪問、治験データの確認、GCP遵守状況の確認)
◆ 症例報告書(CRF)の確認
◆ 治験薬の管理状況確認
◆ 治験担当者とのコミュニケーション
◆ 逸脱事例への対応治験終了時期(終了処理時期) 治験を終了するために、データの回収・確認、総括報告書の作成、規制当局への報告などを行う時期。 ◆ データの最終確認作業に時間を要する場合がある。
◆ 多くの資料作成が必要となり、締め切りに追われる。
◆ 関係各所との調整業務が増える。◆ 症例データの固定(データロック)
◆ 総括報告書作成
◆ 治験関連資料の整理・保管
◆ 治験薬の回収・返却
◆ 規制当局への報告その他 ◆ 監査対応: 製薬会社や規制当局による監査が行われる場合、その対応に追われる。
◆ プロトコル改訂: 治験実施計画書(プロトコル)が改訂された場合、関連する業務が増加する。
◆ 緊急対応: 重篤な有害事象が発生した場合など、緊急の対応が必要となる場合がある。上記の時期以外でも、これらの要因によって一時的に業務量が増加することがある。 ◆ 監査資料の準備
◆ プロトコル改訂に伴う資料修正・関係者への周知
◆ 緊急対応に関する資料作成・報告忙しさの程度(全体) 繁忙期は、通常期と比較して業務量が大幅に増加し、残業時間も増える傾向にある。ただし、企業の規模や担当する治験の数、個人の業務効率などによって、忙しさは異なる。 企業の規模や担当する治験の数、個人の業務効率などによって異なるが、一般的には、
◆ 残業時間: 月20〜40時間程度(繁忙期はそれ以上になる場合もある)
◆ 休日出勤: 必要な場合がある上記に加えて、
◆ 出張に伴う移動時間
◆ 複数のプロジェクトを同時並行で担当する場合の調整業務
◆ 関係各所とのコミュニケーション
なども忙しさに影響する
※CRA転職に特化したAIアシスタントを利用したい方はこちらから


















 年収査定はこちら
年収査定はこちら
 合格予想はこちら
合格予想はこちら
 掲示板で質問をする
掲示板で質問をする





 CRA
CRA

 CRAの
CRAの
 CRAの
CRAの
 CRAの
CRAの
 CRAの
CRAの
 CRAに
CRAに
 CRAの
CRAの
 CRO
CRO
 CRO
CRO
 臨床開発
臨床開発
 製薬会社と
製薬会社と
 CROから
CROから



 2026年4月からの転職
2026年4月からの転職 CRA未経験特集
CRA未経験特集 薬剤師特集
薬剤師特集 MR特集
MR特集 看護師特集
看護師特集 臨床検査技師特集
臨床検査技師特集 保健師特集
保健師特集 獣医師特集
獣医師特集 理系大卒・院卒特集
理系大卒・院卒特集 CRC経験者特集
CRC経験者特集


 求人検索
求人検索  ログイン
ログイン 会員さま専用
会員さま専用 CRAの仕事
CRAの仕事  臨床開発業界の研究
臨床開発業界の研究 経験・資格別の注意点
経験・資格別の注意点 応募書類の作成
応募書類の作成 面接・適性検査の対策
面接・適性検査の対策 みんなのクチコミ
みんなのクチコミ みんなの質問と回答
みんなの質問と回答 転職成功事例
転職成功事例 便利な機能
便利な機能 相談/年収査定/合格予想
相談/年収査定/合格予想 2026年から働くには?
2026年から働くには? 退職手続き
退職手続き 開催中のキャンペーン
開催中のキャンペーン 《CRAばんく》とは
《CRAばんく》とは