「シミック株式会社のその他の評判のクチコミ一覧」のページです。クチコミの閲覧と投稿が可能です。マナーを守って有意義に使いましょう。(削除申請はこちらからお願いします)
シミック株式会社のその他の評判のクチコミ一覧

 企業情報
企業情報
 設立
設立- 2012年1月4日
 代表者
代表者- 代表取締役社長執行役員 三嶽 秋久
 従業員数
従業員数- 2,474名(2024年3月現在) ※シミックホールディングス持分法適用会社含む7,811名(2025年10月1日現在)
 資本金
資本金- 1億円
 本社所在地
本社所在地- 東京都港区芝浦1-1-1
 ホームページ
ホームページ- https://www.cmicgroup.com/
 総合評価
総合評価

 シミック株式会社
シミック株式会社 業界平均
業界平均
総合評価
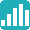
58.9点
(218件の平均)
- 平均年収
- 約535万円 (58人)
- 平均残業時間
- 約28.6時間/月(14人)
 分析
分析
評価の推移
※218名のCRAばんくのクチコミをもとに作成(調査期間:2016年1月~2026年3月、有効回答数:N=218)。
 シミック株式会社のその他の評判のクチコミ一覧
シミック株式会社のその他の評判のクチコミ一覧
- CRA(臨床開発モニター) の仕事のやりがい

-
- 良い点
内部就労、外部就労のどちらも担当する可能性があります。また、配属や上司によって習得できるキャリアが異なります。
・内部就労
優秀な上司(例:製薬会社を経験していて、英語も堪能など)の下で働けると色々と学べるためモチベーション高く仕事ができます。その反面、会社に長く在籍しているだけの上司だったりすると、マネジメントスキルが低く、不要な残業が増えることも多いです。横のつながりが強くないため、どのような上司の下で働けるかはとても大切です。
・外部就労
派遣先によって就業環境が異なりますが、一般的には内部就労よりも経験を積めることが多いと言われています。ただし、社内のキャリアには反映されづらい部分があるため、今後も長くシミックでキャリアを積んでいきたい方にとってはデメリットとなります。将来、メーカーへの転職を考えている人にとっては製薬会社での仕事の仕方を覚えられるため有利になります。
- 悪い点
自分の能力が低かったり、周囲からの評価が低いと、独り立ちできる時期が遅くなり、社内のサポート業務を行う日々が続くことになります。また、プロジェクトにも様々なものがあり、新薬の上市と既存薬の適応拡大では、習得できるスキルにかなり差が発生しますが、自分が携わるプロジェクトは選べないことが多いです。
 CRA(臨床開発モニター)
CRA(臨床開発モニター)
 20代後半
20代後半
 その他
その他
 男性
男性
 2016年
2016年
 2016年4月28日
2016年4月28日 - 良い点
- CRA(臨床開発モニター) の人間関係

-
- 良い点
かなり風通しの良い社風です。上司や役員に対しても「さん」づけで呼んでいます。製薬会社から転職してきた人も多く、社歴序列的な昇進制度であることもあって、事前に説明を受けた競争でベンチャー的というよりもみんなで仲良く保守的な大手企業といったまったり感があると思いました。
- 悪い点
給料が低く上がらないことに対して不満を持っている人が多いです。会社は経費削減によって利益を出すことに力を入れており、今後も給料が大きく上がっていく可能性は低いと思います。また、良いキャリアを積めるかどうかは上司やプロジェクト次第であるため、同時期に入社した方でも数年が経過すると本人の知らないところで転職市場での価値には大きな差がついてしまいます。女性管理職は少ないですが、気が強い女性が多いと思います。
 CRA(臨床開発モニター)
CRA(臨床開発モニター)
 20代後半
20代後半
 その他
その他
 女性
女性
 2016年
2016年
 2016年4月3日
2016年4月3日 - 良い点
- CRA(臨床開発モニター) の福利厚生・休日

-
- 良い点
女性が多いため、働く環境も整っています。
育休は取得しやすく、復帰後はフレックスで時短勤務が可能です。ポジションもパート感覚で仕事を続ける内勤か、給与を維持してキャリアアップが可能な外勤かを選択して働くことができます。
- 悪い点
育休後の内勤ポジションについては枠に限りがあるため、場合によっては内勤職に戻れないことも発生しているようです。
また、管理職は女性よりも男性が多いため、女性が管理職を目指すのは男性よりも難しい環境かもしれません。
 CRA(臨床開発モニター)
CRA(臨床開発モニター)
 20代後半
20代後半
 その他
その他
 男性
男性
 2016年
2016年
 2016年3月14日
2016年3月14日 - 良い点
- CRA(臨床開発モニター) の福利厚生・休日

-
- 良い点
フレックス制度が導入され非常に働きやすくなりました。残業も全社的に減らしており、ワークライフバランスをとりやすい環境になりました。有給も取得しやすいです。
- 悪い点
定時で退社する人と終電まで残業する人が混ざっている職場ですが、仕事が終わっていれば先に退社しても問題ありません。
 CRA(臨床開発モニター)
CRA(臨床開発モニター)
 30代前半
30代前半
 その他
その他
 女性
女性
 2016年
2016年
 2016年2月14日
2016年2月14日 - 良い点
- CRA(臨床開発モニター) の成長性・安定性

-
- 良い点
・大手であり今後も会社は大きくなっていくと思われる。
・製造からコンサルまで幅広い業務に対応できる。
- 悪い点
・グローバル試験... ログインor無料の転職相談に申込みをして続きを閲覧する
 CRA(臨床開発モニター)
CRA(臨床開発モニター)
 30代前半
30代前半
 その他
その他
 男性
男性
 2013年
2013年
 2015年12月30日
2015年12月30日 - 良い点
- CRA(臨床開発モニター) の教育研修制度

-
- 良い点
教育体制はきちんと整っており心強いです。ベテラン~中堅のCRAも多く、実務を通して成長できる環境があります。
- 悪い点
DMの部署はCRA以上... ログインor無料の転職相談に申込みをして続きを閲覧する
 CRA(臨床開発モニター)
CRA(臨床開発モニター)
 30代前半
30代前半
 その他
その他
 女性
女性
 2015年
2015年
 2015年11月27日
2015年11月27日 - 良い点
- CRA(臨床開発モニター) の福利厚生・休日

-
- 良い点
女性は働きやすい環境です。育休後も内勤か外勤を選べるので選択肢が多く、時短勤務も利用できます。会社としては残業を減らしてワークライフバランスを重視する方向に舵をきっています。
女性でも能力の高い方、やる気の高い方はどんどん出世していきます。
- 悪い点
男性にとっては長期的に在籍するメリットがあまり見い出せないため、転職する方も多いです。
 CRA(臨床開発モニター)
CRA(臨床開発モニター)
 20代後半
20代後半
 その他
その他
 女性
女性
 2014年
2014年
 2015年11月16日
2015年11月16日 - 良い点
- 事務 の成長性・安定性

-
- 良い点
N社長:アグレッシブでフレンドリーです。無限のパワーがある方です。
- 悪い点
早口でいつも熱血... ログインor無料の転職相談に申込みをして続きを閲覧する
 事務
事務
 20代後半
20代後半
 その他
その他
 女性
女性
 2014年
2014年
 2015年11月13日
2015年11月13日 - 良い点
- CRA(臨床開発モニター) の仕事のやりがい

-
- 良い点
外部就労の場合は派遣先の製薬会社の評価が大きいです。そのため、仕事の成果よりも製薬会社と上手に仕事をしているかを大切にしたほうが良いと思います。単独、チームのどちらで派遣される場合もありますが、内部就労よりもキャリアを積めると思います。また、将来的に製薬会社への転職や移籍をしたい方は、製薬会社で働くことでしか習得できないキャリアがあり、人脈のパイプも大きくなるため、外部就労のほうが良いと思います。
- 悪い点
外部就労の場合はシミックに戻ることはほとんどありません。そのため、シミックで出世をしたい人にとってはデメリットのほうが多いかもしれません。また、チームで派遣される場合を除けば、単独で業務を行うことも多いため、寂しがりやの人には向いていないと思います。
 CRA(臨床開発モニター)
CRA(臨床開発モニター)
 30代前半
30代前半
 その他
その他
 男性
男性
 2015年
2015年
 2015年11月6日
2015年11月6日 - 良い点
- CRA(臨床開発モニター) その他の成長性・安定性

-
- 良い点
業界最大手の1社であり、ブランド力もあります。業界自体も成長しているため、まだまだ成長の余地はあると思います。
- 悪い点
グループ企業の不... ログインor無料の転職相談に申込みをして続きを閲覧する
 CRA(臨床開発モニター) その他
CRA(臨床開発モニター) その他
 30代前半
30代前半
 その他
その他
 男性
男性
 2015年
2015年
 2015年10月28日
2015年10月28日 - 良い点
66 件中 41 ~ 50 を表示中










 年収査定はこちら
年収査定はこちら
 合格予想はこちら
合格予想はこちら
 掲示板で質問をする
掲示板で質問をする





 CRA
CRA

 CRAの
CRAの
 CRAの
CRAの
 CRAの
CRAの
 CRAの
CRAの
 CRAに
CRAに
 CRAの
CRAの
 CRO
CRO
 CRO
CRO
 臨床開発
臨床開発
 製薬会社と
製薬会社と
 CROから
CROから



 薬剤師特集
薬剤師特集 MR特集
MR特集 看護師特集
看護師特集 臨床検査技師特集
臨床検査技師特集


 求人検索
求人検索  ログイン
ログイン 会員さま専用
会員さま専用 CRAの仕事
CRAの仕事  臨床開発業界の研究
臨床開発業界の研究 経験・資格別の注意点
経験・資格別の注意点 応募書類の作成
応募書類の作成 面接・適性検査の対策
面接・適性検査の対策 みんなのクチコミ
みんなのクチコミ みんなの質問と回答
みんなの質問と回答 転職成功事例
転職成功事例 便利な機能
便利な機能 相談/年収査定/合格予想
相談/年収査定/合格予想 2026年から働くには?
2026年から働くには? 退職手続き
退職手続き 開催中のキャンペーン
開催中のキャンペーン 《CRAばんく》とは
《CRAばんく》とは